Les acides aminés sont des molécules polyfonctionnelles qui comportent au moins une fonction acide carboxylique et une fonction amine. Ce sont des acides a-aminés (alpha-aminés) ce qui signifie que les groupes carboxylique et amine sont portés par le même atome de carbone. Cet atome de carbone (Ca ) est un carbone asymétrique ou carbone chiral, excepté pour l'acide aminé le plus simple appelé glycine ou glycocolle.
Les acides aminés naturels sont au nombre de 20. Ils se différencient les uns des autres par la nature de leur chaîne latérale (R). Chaque acide aminé aura des propriétés chimiques particulières qui seront déterminées par les caractéristiques de sa chaîne latérale.
Les chaînes latérales sont souvent classées selon leur polarité et leur charge électrique à pH 7 :
La nature de la chaîne latérale R influence quatre paramètres importants :
La proline est un acide aminé très particulier, il n'a pas de groupe aminé libre mais celui-ci est engagé dans un cycle avec la chaîne latérale hydrocarbonée. La proline a un rôle très important dans la structure spatiale. Du fait de la conformation particulière de la molécule, elle impose des changements de direction dans les protéines.
La cystéine est un acide aminé qui possède une fonction thiol (-SH). La fonction thiol s'oxyde facilement en disulfure (-S-S-). Les ponts disulfure sont extrêmement importants dans la structure spatiale tridimensionnelle des protéines. Une protéine qui possède de nombreux ponts disulfure est en général très stable (difficilement dénaturée).
2 Cy -SH ® Cy-S-S-Cy + 2H+ + 2e-
L'oxygène de l'air peut servir d'agent oxydant (accepteur d'électrons
et de protons).
Les disulfure appartenant à d'autres protéines peuvent aussi être
oxydants vis à vis des thiols d'une protéine donnée. C'est
une réaction très particulière appelée interchange
thiol-disulfure. Cette réaction est très importante aussi bien
au niveau métabolique dans les cellules, qu'au niveau technologique dans
les processus de transformation en agroalimentaire, par exemple dans la fabrication
du pain.
La lysine qui est un acide aminé basique avec une fonction amine dans la chaîne latérale est souvent impliquée dans une suite de réactions complexes de condensation avec les glucides. Les réactions en question sont connues sous le nom de réactions de Maillard et sont extrêmement importantes dans la chimie des produits agroalimentaires.
L'histidine joue également un rôle dans les réactions de Maillard par l'intermédiaire de l'azote de sa chaîne latérale. L'histidine, tout comme les autres acides aminés présents dans le site catalytique des enzymes et qui sont chargés positivement ou négativement à pH 7, est souvent impliquée dans le mécanisme réactionnel des réactions enzymatiques.
La nature hydrophobe ou hydrophile de la chaîne latérale est un
élément qui a une grande importance sur la structure tertiaire
des protéines.
Ce paramètre est mesuré par l'index d'hydropathie
des acides aminés. L'index d'hydropathie est d'autant plus élevé
que la molécule porte une chaîne latérale apolaire.
Une chaîne latérale sera décrite comme hydrophobe (ou apolaire)
si elle est constituée uniquement d'atomes de carbone et d'atomes d'hydrogène
en chaîne aliphatique ou cyclique.
Inversement une chaîne latérale d'acide aminé sera considérée
comme hydrophile (ou polaire) si elle est chargée électriquement
ou encore si elle contient des atomes susceptibles de polariser les liaisons,
en particulier des atomes d'oxygène ou des atomes d'azote.
L'isomérie optique des acides aminés
provient de leur carbone chiral. Seule une des deux séries d'énantiomères
est représentée dans les biomolécules. Les acides aminés
naturels sont de la série L.
La représentation des formules des acides aminés en projection
de Fischer permet de systématiser l'écriture en 2 dimensions (sur
une feuille de papier ou sur l'écran d'ordinateur) des différents
acides aminés pour rendre contre de leur conformation en 3D.
Les acides aminés absorbent tous la lumière ultraviolette au
voisinage de 220 nm. L'étude des spectres d'absorption des différents
acides aminés révèle que les trois acides aminés
aromatiques ( Try, Phe, Tyr) ont un deuxième pic d'absorption à
une longueur d'onde plus élevée : au voisinage de 280 nm.
Comme toutes les protéines possèdent des résidus aminoacyles
aromatiques, cette propriété d'absorption à 280 nm est
mise à profit pour détecter simplement, par mesure spectrophotométrique,
la présence de protéines dans un liquide donné.
Les fonctions alpha-carboxylique et alpha-aminée des acides aminés ont des pKa très différents : de l'ordre de 2 pour la fonction carboxylique et de l'ordre de 9 pour la fonction amine.
La dissociation de chaque groupe se fera donc à des pH distincts.
+H3N- CH(R)- COOH ![]() +H3N- CH(R)- COO-
+H3N- CH(R)- COO- ![]() H2N- CH(R)- COO-
H2N- CH(R)- COO-
La forme ionique intermédiaire est un zwitterion ou ion dipolaire. C'est également une espèce amphotère puisqu'elle a les propriétés d'une base pour la première réaction de dissociation et les propriétés d'un acide pour la deuxième réaction de dissociation.
Le pH où existe le zwitterion comme forme majoritaire et où la
concentration de AA+ est égale à la concentration de
AA- est par définition le point isoélectrique ou point
isoionique (pI) de l'acide aminé.
Dans le cas où la chaîne latérale de l'acide aminé
ne porte pas de groupes dissociables, le pI de l'acide aminé est égal
à la demi-somme des pKa de la fonction alpha -carboxylique et de la fonction
alpha-aminée.
Si la chaîne latérale possède des groupes ionisables en
fonction du pH, il faut identifier l'espèce chimique qui correspond au
zwitterion en écrivant les différentes réactions de dissociation.
La valeur du pI sera donnée par la ½ somme des pKa qui réactions
de dissociation qui entourent le zwitterion.
La calcul plus précis de la charge globale nécessite de connaître la concentration des espèces ioniques présentes en solution. Ceci peut se faire en utilisant la relation de Henderson- Hasselbach :
pH = pKa + log [base conjuguée] / [acide]
· leur différence de charge électrique à un pH donné ( différence de pI)La différence de charge électrique permet une séparation par les techniques d'électrophorèse ou par des techniques chromatographiques par échange d'ions sur une résine.
· leur différence de polarité
La différence de polarité est déterminante pour la séparation
par des techniques chromatographiques (chromatographie de partage sur couche
mince ou par séparation à contre-courant).
Il existe, par ailleurs, diverses réactions de coloration spécifiques d'acides aminés ; par exemple le réactif de Folin pour les acides aminés aromatiques (Phe, Trp, Tyr), le réactif de Sakaguchi pour l'arginine…
Ces réactions colorées peuvent être utilisées pour réaliser des dosages colorimétriques des acides aminés.
+H3N- CH(R1)- COO- ++H3N- CH(R2)- COO- ®+H3N- CH(R1)- CO - HN- CH(R2)- COO- + H2O
En couplant 2 acides aminés, on obtient un dipeptide. On dénommera tripeptide, tétrapeptide ou pentapeptide … la molécule obtenue selon son nombre de résidus.
Un oligopeptide est une chaîne ne comprenant que quelques résidus
: de 2 à 10 ou 20.
Un polypeptide est une dénomination synonyme de protéine.
Quand on regarde la formule d'un dipeptide, on se rend compte que la chaîne a un sens. Une des extrémités porte un groupe amine alors que l'autre extrémité porte un groupe carboxylique.
+H3N- CH(R1)- CO - HN- CH(R2)- COO-
Par convention, on attribue à la chaîne le sens N-terminal ®
C-terminal: on lira les résidus présents en partant de l'extrémité
N-terminale et en allant vers l'extrémité C-terminale.
La configuration trans est beaucoup plus stable que la configuration cis parce
qu'il y a moins de gêne sur le plan stérique pour les 2 groupes
R adjacents. C'est donc essentiellement sous la configuration trans que seront
distribués les atomes autour de la laison peptidique.
+H3N- CH(R1)- CO - HN- CH(R2)- COO-
Du fait de la présence de l'oxygène qui est fortement électro-attracteur , les électrons de la liaison peptidique vont être attirés du côté de l'oxygène en polarisant ainsi la liaison C-N. L'oxygène prend une charge négative partielle, alors que l'azote donne son doublet d'électrons libres et prend une charge positive partielle. De ce fait, les électrons entre l'oxygène et l'azote sont délocalisés. Il existe une forme intermédiaire hybride entre les 2 formes limites en résonance.
|
||||
La conséquence de cette délocalisation électronique est que les six atomes dessinés en rouge dans la formule du dipeptide sont dans le même plan. Ce plan est appelé plan amide.
Dans une chaîne polypeptidique, il existe autant de plans amide que de
liaisons peptidiques.
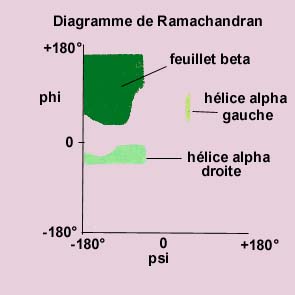
| On caractérise la position spatiale d'un plan amide par rapport
à son voisin en définissant 2 angles de rotation : l'angle
psi (Y) qui est l'angle de rotation autour
de la liaison Ca-C (de C=O) du plan 1 et l'angle
phi (F) qui est l'angle de rotation autour
de la liaison Ca-N (de N-H) du plan 2. Toutes les valeurs d'angles ne sont pas permises. Le diagramme qui représente les valeurs possibles d'un des angles en fonction de l'autre s'appelle diagramme de Ramachandran. Le diagramme indique les zones où existent les différents types de structure spatiale (structure tertiaire). |
 |
Cours d'Analyse de la structure primaire des protéines
Le premier niveau de l'organisation dans l'espace de la chaîne peptidique
, compte tenu de l'existence des différents plans amide se fait selon
deux types de structure :
· l' hélice a
(alpha)
· le feuillet b (bêta) Ces deux types de structure sont stabilisés par de nombreuses liaisons hydrogène, parallèles à l'axe de l'hélice pour l'hélice a et perpendiculaires à l'axe de la chaîne pour le feuillet b.
L'hélice a (alpha) est plus compacte, moins
étirée que le feuillet b (bêta).
Les fragments de la chaîne polypeptidique organisés en hélices
ou en feuillets sont reliés par des petits segments polypeptidiques appelés
coudes ou coudes b (bêta). Les coudes permettent
un changement de direction (une boucle) dans la chaîne polypeptidique
permettant de réaliser un reploiement de la macromolécule protéique.
Il existe également des portions de chaîne qui ne sont pas organisées
de façon régulière. Ces fragments se replient de manière
plus ou moins aléatoire. Ces zones plus désorganisées que
le reste de la chaîne s'appelle pelote statistique.
| Dans la chaîne peptidique, des portions d'environ dix résidus
adoptent une configuration donnée : hélice alpha ou feuillet
bêta. Il en résulte qu'une protéine est constituée
par une succession de parties en hélices ou en feuillets, séparées
par des fragments en pelotes statistiques. La chaîne est donc repliée
maintes fois. Les changements de direction dans la chaîne sont assurés
par les coudes. Certaines protéines, comme la myoglobine, sont constituées essentiellement d'hélices ; d'autres protéines sont constituées essentiellement de feuillets , c'est le cas des anticorps ; d'autres enfin sont des assemblages de parties en hélices et en feuillets. En général 60 à 70% des protéines ont une stricte organisation spatiale, le reste de la molécule est sous forme de pelote statistique. |
 |

Un certain nombre de protéines possèdent un niveau supérieur d'organisation : elles sont assemblées en plusieurs sous-unités semblables ou différentes. Ces protéines, dans le cas où elles ont une fonction enzymatique, ont un rôle capital dans la régulation du métabolisme. Ce sont les enzymes allostériques.
| Biochimie | Structurale | et | Analytiqueã | Danielle | et | Khanh | Lê-Quôc | 1999-2000 |